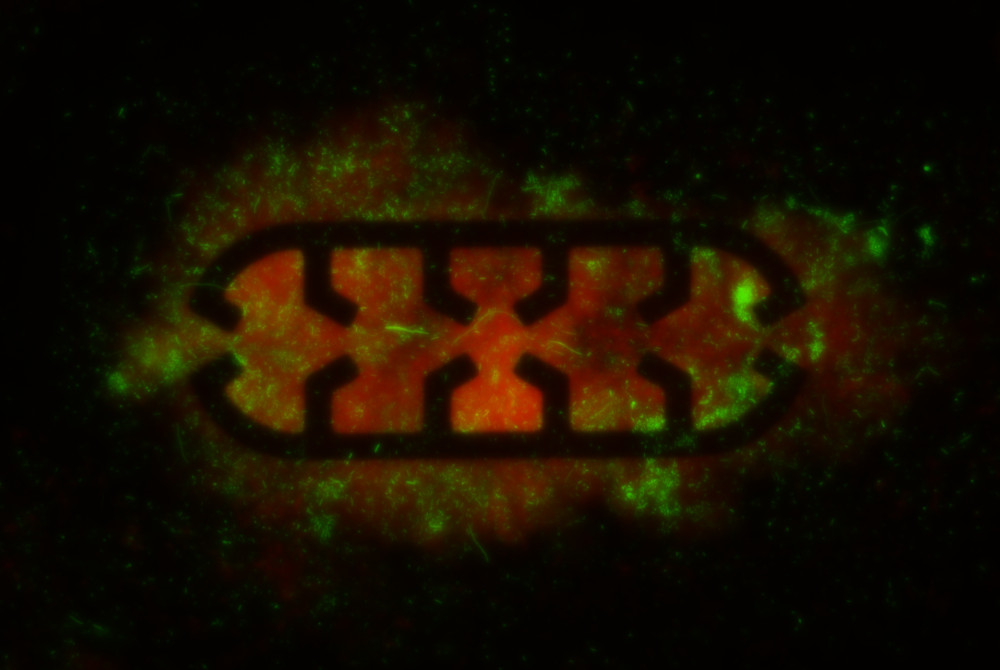
Mikroskopisches Bild eines zweifach fluoreszierenden E. coli-Biofilms: Lage der Bakterien (rot), Expression ausgewählter biofilmbezogener Gene (grün)
Quelle: BAM
Mikroorganismen kommen häufig in Umgebungen vor, die durch Flüssigkeitsströmungen gekennzeichnet sind. Wenn sie sich in industriellen oder klinischen Umgebungen an Oberflächen festsetzen, können sie eine Reihe von Problemen verursachen, wie z. B. Korrosion und Materialabbau, oder potenzielle Gesundheitsrisiken darstellen. Um diesen Herausforderungen zu begegnen, ist es wichtig, das Wissen über die Bildung von Biofilmen unter Strömungsbedingungen zu erweitern. In diesem Artikel wird eine neuartige mikrofluidische Plattform zur Untersuchung von Biofilmen vorgestellt, die eine präzise Kontrolle über kritische Umgebungsfaktoren wie Temperatur, biochemischen oder Durchflussparametern gewährleistet. Im Gegensatz zu statischen Untersuchungen oder großen Durchflusskammern basiert diese Plattform auf einer mikrofluidischen Einkanal-Durchflusszelle, die einen konsistenten und gleichmäßigen Fluss gewährleistet. Durch die Integration von Mikrostrukturen, die Bakterien gezielt einfangen (Mikrofallen), ist ein Echtzeitmonitoring der Biofilmbildung unter verschiedenen Strömungsbedingungen möglich, bei exakter Kontrolle der Umgebungsbedingungen und geringem Bedarf an Reagenzien, Darüber hinaus erlaubt der Einsatz von Strömungssimulationen und der Verfolgung von Fluoreszenzpartikeln zur Analyse der Bakterienbewegung die Erfassung präziser Daten über Strömungsgeschwindigkeit und -richtung auf mikroskopischer Ebene. Es konnte nachgewiesen werden, dass der Einbau von Mikrofallen in den Kanal zur Erzeugung von lokalisierten Mikrowirbeln führt, was das Einfangen von Bakterien in bestimmten Bereichen erleichtert und dadurch Einblicke in die Beeinflussung der Biofilmbildung durch die Hydrodynamik bietet. Im Vergleich zu anderen Methoden zeichnet sich dieser Ansatz durch ein höheres Maß an Kontrolle über die räumliche Dynamik und eine detailliertere Analyse des Biofilmverhaltens aus. Das erweiterte Verständnis der Biofilmbildung birgt das Potenzial zur Entwicklung wirksamerer antimikrobieller Strategien beizutragen, wie beispielsweise zur Schaffung verbesserter Oberflächenbeschichtungen und Materialmodifikationen. Zukünftige Weiterentwicklungen könnten die Einbeziehung von gemusterten Oberflächen, automatischer Bildgebung und chemischer Echtzeit-Sensorik umfassen und so den Wert der Plattform für die Untersuchung der Widerstandsfähigkeit von Biofilmen, der antimikrobiellen Resistenz und der Wechselwirkungen zwischen Biofilmen und verschiedenen Materialien erhöhen.
Microfluidic Platform with Precisely Controlled Hydrodynamic Parameters and Integrated Features for Generation of Microvortices to Accurately Form and Monitor Biofilms in Flow
Keqing Wen, Anna A. Gorbushina, Karin Schwibbert, Jérémy Bell
ACS Biomaterials Science & Engineering. 2024, 10, 7, 4626–4634


